
今天给大家分享中考化学必考题型——溶解度曲线,还没中考的同学可以拿来复习,准初三的同学可以收藏,为明年中考做好准备~
必备知识点
一、饱和溶液、不饱和溶液
1.饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做饱和溶液。
2.不饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质还能继续溶解时的溶液,叫做不饱和溶液。
3.饱和溶液、不饱和溶液的转化方法:大多数情况下饱和溶液和不饱和溶液存在以下转化关系(溶质为固体):
4.判断溶液是否饱和的方法:
一般说来,可以向原溶液中再加人少量原溶质,如果溶解的量不再增大则说明原溶液是饱和溶液,如果溶解的量还能增大则说明原溶液是不饱和溶液。
二、溶解度、溶解度曲线
1.固体的溶解度:
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。如果不说明溶剂,通常所说的溶解度是指物质在水里的溶解度。2.正确理解固体的溶解度概念需要抓住四个因素:
(1)一定温度。同一种固体物质在不同温度下对应的溶解度是不同的,因此必须指明温度。
(2)100g溶剂。此处100 g是指溶剂质量,不能误认为溶液质量。
(3)饱和状态。在一定温度下,某固态物质在100g溶剂里所溶解的最大质量为这种物质在这种溶剂里的溶解度。
(4)单位:g3.影响固体溶解度的因素:(1)溶质、溶剂的性质;(2)温度。4.固体物质的溶解度与溶解性的关系:
20℃溶解度/g |
>10 |
10~1 |
1~0.01 |
<0.01 |
物质的溶解性 |
易溶 |
可溶 |
微溶 |
难溶 |
实例 |
NaCl |
KClO3 |
Ca(OH)2 |
CaCO3 |
5.溶解度曲线:(1)当溶质一定、溶剂一定时.固态物质的溶解度主要受温度的影响,也就是说,固态物质的溶解度是温度的函数。这种函数关系既可用表格法表示,也可以用图像法(溶解度曲线)来表示。用纵坐标表示溶解度,横坐标表示温度,得到物质溶解度随着温度变化的曲线,这种曲线叫做溶解度曲线。 (2)温度对固体溶解度的影响规律①大多数物质的溶解度随温度升高而增大(如KNO3)②少数物质的溶解度受温度影响不大(如NaCl)③极少数物质的溶解度随温度升高而减小(如Ca(OH)2)
(3)溶解度曲线的意义及应用
①根据溶解度曲线可以查出某温度下该物质的溶解度;也可以查出该物质已知溶解度所对应的温度。曲线上的点即该物质对应温度时的溶解度,按其数据配成的溶液正好为饱和溶液;若按曲线下面的任何一点的数据所配溶液,均为该温度下该物质的不饱和溶液;如按曲线上面任何一点所表示的数据配制溶液,溶液中均含有未溶解的晶体,所配溶液为饱和溶液。②固体物质的溶解曲线主要有三种情况:“陡升型”,该类物质(大多数固体物质)的溶解度随温度升高而明显增大;“缓升型”,这类物质(少数固体物质)的溶解度随温度升高变化不明显;“下降型”,它(极少数物质)的溶解度随温度升高而减小。③不同物质在同一温度下的溶解度借助不同物质的溶解度曲线,可比较相同温度下各物质溶解的大小。④几种物质溶解度曲线的交点,表示对应温度下几种物质的溶解度相等。
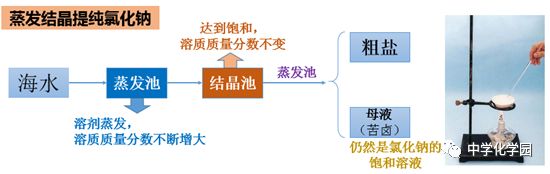
三、结晶
(1)蒸发结晶
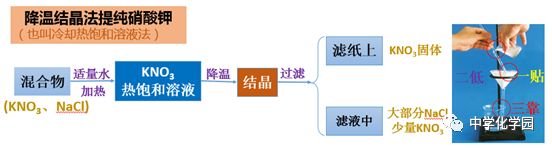
(2)降温结晶法(冷却热饱和溶液法)
练一练
1.分析下表中KCl和KNO3的溶解度数据,回答相关问题。
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
溶解度/g |
KCl |
27.6 |
34.0 |
40.0 |
45.5 |
51.1 |
56.7 |
KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
|
(1)在KCl和KNO3中,溶解度受温度影响较大的是 ;
(2)欲将55g KNO3固体完全溶解,至少需要 g 60℃的水;
(3)KNO3溶液中含有少量KCl,提纯KNO3晶体,宜采用的结晶方法是 ,若要完全提纯KNO3晶体,采用的化学方法是向混合溶液中加入适量的某种溶液,充分反应后过滤,再对滤液蒸发即可,发生反应的化学方程式为 。
【答案】(1)KNO3;(2)50;(3)降温结晶;AgNO3+KCl=AgCl↓+KNO3。
2.如表格是甲乙丙三种物质在不同温度下的溶解度(单位g),如图是KNO3、NaCl两种固体的溶解度曲线,请结合表格和曲线回答下列问题
0℃ |
30℃ |
60℃ |
90℃ |
|
甲 |
13.3
|
45.8 |
110 |
202 |
乙 |
35.5 |
36.0 |
37.1 |
38.1 |
丙 |
0.18 |
0.16 |
0.12 |
0.08 |
(1)甲、乙、丙三种物质中可能是硝酸钾的是 ;
(2)欲使30℃时丙的饱和溶液转化为不饱和溶液,除加溶剂外还可以采取的方法是 ;
(3)在30℃时,将50g甲放入100g水中,充分搅拌。所得溶液的质量约为 g,将此混合物升温到90℃时,以下说法正确的是
A.甲的溶解度变大 B.甲溶液的质量变大 C.溶液中甲的质量分数不变
(4)KNO3中混有少量NaCl,提纯KNO3采取 结晶方法。
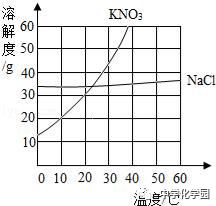
【解析】(1)甲、乙、丙三种物质中可能是硝酸钾的是甲,因为甲的溶解度受温度的影响比较大;故答案为:甲;(2)欲使30℃时丙的饱和溶液转化为不饱和溶液,除加溶剂外还可以采取的方法是:降低温度,因为丙的溶解度随温度的升高而减小;故答案为:降低温度;(3)在30℃时,将50g甲放入100g水中,充分搅拌,所得溶液的质量=45.8g+100g=145.8g;将此混合物升温到90℃时,说法正确的是:甲的溶解度变大;甲溶液的质量变大;故答案为:145.8;AB;(4)KNO3中混有少量NaCl,提纯KNO3采取降温结晶方法,因为硝酸钾的溶解度随温度的升高变化比氯化钠大;故答案为:降温。
3.分析甲、乙两种固体的溶解度曲线,回答下列问题。
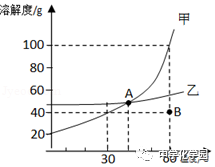
(1)A点表示 。
(2)若B点表示60℃时将40g甲放入100g水中,将其变成恰好饱和的溶液的方法之一: 。
(3)若B点表示60℃时乙物质的 (填饱和溶液或不饱和溶液),此温度下其溶质的质量分数为 。(结果保留0.1%)
【答案】(1)A℃时,甲、乙两种固体的溶解度相同;(2)加60g甲;(3)不饱和,28.6%。
4.下表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
溶解度/g |
氯化钠 |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
硝酸钾 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
|
氢氧化钙 |
0.19 |
0.17 |
0.14 |
0.12 |
0.09 |
0.08 |
|
(1)60℃时,氯化钠的溶解度 硝酸钾的溶解度(填“>”=“或“<”);
(2)表中某物质的饱和溶液随温度升高析出固体,该物质是 (填化学式);
(3)20℃时,氯化钠饱和溶液中溶质的质最分数为 (结果保留至0.1% );
(4)向20℃的氢氧化钙饱和溶液中加入少量生石灰,再冷却至20℃.此时溶液中溶质的 质量比加入生石灰前溶液中溶质的质量 (填“增大”“不变”或“减小”)。
(3)将氢氧化钙饱和溶液转化为不饱和溶液,可采取的方法有蒸发溶剂,还有 。
【答案】(1)<;(2)Ca(OH)2;(3)26.5%;(4)减少。(5)降低温度
说明:综合整理by中学化学园,转载请先联系并注明出处,违者必究~

更多精彩内容欢迎关注:中学化学园~
高中化学学生交流:
初中化学学生交流:
 点击“阅读全文”,观看更多科普视频~
点击“阅读全文”,观看更多科普视频~



版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌侵权/违法违规的内容,请联系我们,一经查实,本站将立刻删除。
如需转载请保留出处:https://51itzy.com/kjqy/58128.html